【前沿背景】
大多数接触活性物质在水中的溶胀度不高。但是,许多生物材料应用都需要使用水凝胶。后者具有独特的特质,例如减震,低滑动分数和对刺激敏感的肿胀/溶胀,因此在医学等多个领域都很重要,例如组织工程,卫生应用,人造软骨,软骨再生,植入进入皮下组织,角膜修复材料,伤口和手术密封剂,药物递送库,伤口护理材料,人造肌肉和组织修复。在Ng等人(DOI: 10.1016/j.addr.2014.10.028)和Malmsten (DOI: 10.1039/c1sm05809f)的评论中讨论了抗微生物活性水凝胶的重要性。
已知杀死其表面上的微生物的水凝胶的几个例子。Liu等人(DOI: 10.1002/adma.201202225)发表了一种原位形成的抗菌和防污水凝胶,该凝胶可以应用在植入物(如导管)上作为涂层,由含有季铵基团的聚碳酸酯和聚乙二醇制成,该涂层在14天内有效,并且没有抑制作用琼脂平板测定中的区域。Salick等人(DOI: 10.1002/adma.200900189)设计了β-发夹肽水凝胶。可以抑制清洁表面上的潜在感染,也可以将其运送到受感染的位置,在此处细菌细胞可以被杀死。Giano等人(DOI: 10.1038/ncomms5095)通过混合聚葡聚糖醛和支链聚乙烯亚胺溶液,报道了一种固有的,可注射器注射的,生物相容性的抗菌水凝胶。这种用于伤口填充的粘合剂可节省人类红细胞并杀死革兰氏阳性和革兰氏阴性细菌。在所有情况下,抗菌基团都是凝胶功能结构的一部分,并定义了其特性。
【科研摘要】
早前,多特蒙德工业大学Joerg C. Tiller教授团队通过反式1,4-二溴-2-丁烯与N,N,N',N'-四甲基-1,3-丙二胺的加聚反应得到的血液相容性抗菌3,4-en-紫罗烯(PBI)通过它的溴端基使用三(2-氨基乙基)胺(TREN)形成快速膨胀的抗菌超吸水剂。相关论文Cross-Linking of a Hydrophilic, Antimicrobial Polycation toward a Fast-Swelling, Antimicrobial Superabsorber and Interpenetrating Hydrogel Networks with Long Lasting Antimicrobial Properties发表在《ACS Applied Materials & Interfaces》上。这种超级吸水剂在60 s内承担了其重量的30倍,而粒状材料承担了其重量的96倍,形成了水凝胶。它完全可以防止金黄色葡萄球菌的生长。用丙烯酸2-羟乙酯和二甲基丙烯酸甘油酯溶胀PBI网络,然后光聚合以形成互穿的水凝胶(IPH),PBI含量在2.0至7.8重量%的范围内变化。其中一种负责材料性能的聚合物网孔,另一种负责抗菌性能的聚合物网孔。通过原子力显微镜和透射电子显微镜确认了IPH的纳米相结构。即使在最低的PBI浓度下,医院内的金黄色葡萄球菌,大肠杆菌和铜绿假单胞菌的细菌细胞也会被杀死。洗涤水凝胶长达4周后,抗菌活性得以保留。使用一种新的定量检测溶液中PBI的方法,IPH会显示出PBI的少量浸出,远低于其抗菌活性浓度。该浸出不足以形成抑制区并杀死IPH周围的细菌细胞。

这项工作的目的是制备具有最小含量的抗菌功能和可调节性能的接触活性持久的抗菌水凝胶。实现这一目标的概念是制备互穿性水凝胶(IPH),该互穿性水凝胶由血液相容性,亲水性抗菌聚阳离子PBI的高度膨胀的聚合物网络组成,并由基于水凝胶的聚合物网络互穿,从而形成丙烯酸2-羟乙酯(HEA)(示意图1)。

示意图1.抗菌IPH的制备
首先,通过交联先前报道的聚合物PBI制备聚合物网络。通过用各种双键(例如苯乙烯,丙烯酸酯和肉桂酸酯)修饰聚合物,然后进行紫外线辐射,可以实现紫罗烯的交联。在该项工作中,决定对端基进行化学交联,以实现最大程度的溶胀度,这是获得最大可能吸水量所必需的。为此,通过反式1,4-二溴-2-丁烯(DBB)和N,N,N',N'-四甲基-1,3-丙二胺(TMPDA)的加聚反应制备了三种不同的聚合物,随后 最后一步用DBB处理,以确保聚合物所有末端的溴基团。使用1 H NMR,光散射(LS)和尺寸排阻色谱(SEC)对聚合物进行表征,以确定分子量,分子量分布和端基修饰(表1)。

根据这些数据,所有聚合物均显示出加聚反应典型的分子量分布。 通过1 H NMR和SEC确定的Mn值的比较表明,后者值较高,因为1 H NMR仅能高估分子量,原因是它涉及到溴端基。此外,所用的用于校正SEC的支链淀粉标准品与色谱柱材料的相互作用可能较少,这将导致分子量被高估。1H NMR和LS分子量值更接近,表明大多数PBI端基确实被溴基修饰。因此,所有合成的PBI应该是可交联的。然后使聚合物与三(2-氨基乙基)胺(TREN)以不同的NH2/溴端基摩尔比反应(参见表S1)。

表S1.同制备的PBIN的详细组成及其计算的三种不同PBI的NH2 /溴(Br)端基的摩尔比。在所有情况下,使用的PBI储备液的体积(40 wt%,ρ= 1.12 g/mL)均为500 µL。为了交联,对于PBI5700和PBI7000使用5重量%的TREN溶液(ρ=0.98g/mL),对于PBI3100使用10重量%的TREN溶液(δ=0.98g/mL)。
理想情况下,当以1:1的NH2/溴比例添加交联剂TREN时,其效果最好,因为所有端基都可以反应。然后,这将导致水中最低的溶胀度(S)。如图1所示,S随PBI分子量的增加而增加。1:1的比例没有达到最小的溶胀,但是NH2基团过多。
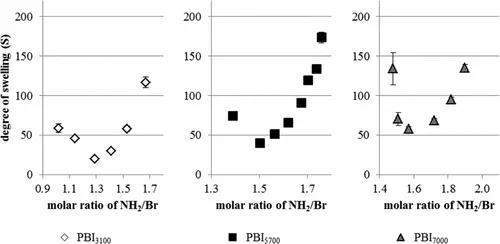
图1. TBI交联的PBI3100,PBI5700和PBI7000的PBI网络在双蒸馏水中的溶胀度(S)对NH2 /溴(Br)端基摩尔比的依赖性。网络在室温下膨胀2小时。
交联实验还表明,NH2/溴的比率和PBI分子量的变化可用于控制溶胀度在20到170之间。这些网络作为快速溶胀,抗菌剂非常有趣超级吸水剂。为了进一步探索这种潜力,在交联的PBI5700的实例上研究了切片PBIN以及通过切割干燥网络制备的颗粒状材料的吸水率。如图2a所示,在室温下仅需一分钟即可完全吸收30倍于PBIN重量的水滴(NH2/溴端基的摩尔比为1.50)。在同一时间段内,PBIN颗粒(NH2/溴端基的摩尔比为1.74)占其重量的48倍,形成水凝胶(图2b)。这种凝胶仍可以在两分钟内吸收相同量的水。PBIN在水中快速溶胀的原因可能是高电荷PBI的强亲水性,这导致了理想的聚合物与水的相互作用。
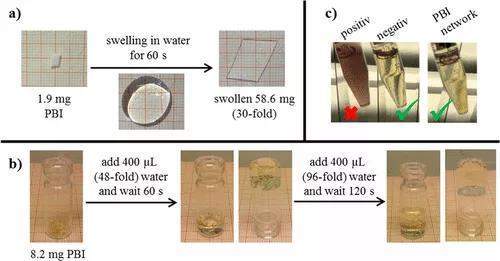
图2. a)和b)PBIN膜(NH2/溴端基的摩尔比为1.50)(a)和粒状PBIN(NH2/溴端基的摩尔比为1.74)(b)在水里的快速溶胀照片。c)装有4 mL生长培养基的15 mL猎鹰管的照片:(左)接种2.5×104S。金黄色葡萄球菌细胞/ mL并在37°C下孵育过夜,(中)在不添加细菌细胞的情况下在37°C孵育过夜,(右)6 mg PBIN(NH2/溴比1.50,用水洗涤五次)用10处理 将μL金黄色葡萄球菌在生长培养基中的悬浮液(107细胞/mL)放置10分钟,添加到生长培养基中,并在37°C下孵育过夜。这些照片是在37°C孵育16小时并用TTC染色后拍摄的。
另外,聚合物网络阻止了医院内细菌金黄色葡萄球菌(金黄色葡萄球菌)的生长。 通过用金黄色葡萄球菌悬浮液处理PBIN 10分钟并将此水凝胶在细菌生长培养基中于37°C孵育过夜,可以证明这一点。在这段时间之后,没有观察到细菌生长(图2c)。
选择分别使用1.74(PBIN1.74)和1.50(PBIN1.50)的摩尔比制备的PBI5700网络用于以下所有实验。通过在HEA(49 wt%),交联剂(0.5 wt%),光引发剂(0.45 wt%)和水的混合物中将相应的PBIN溶胀过夜,将互溶的PBIN进行合成,从而完成互穿水凝胶(IPH)的合成并用紫外线辐射。在用紫外线辐射之前,终止每个PBI网络的溶胀度(S)。由于混合物的复杂性,溶胀程度显示出比水中更大的变化。确定所有准备好的PBIN1.74(1)(S = 57-100)和PBIN1.50(1)(S = 25-36)的溶胀度。基于个体的溶胀度,计算最终干燥网络中的PBI含量。所得互穿水凝胶分别命名为IPH1.50(1)和IPH1.74(1)。计算出IPH1.74(1)的PBI含量在2.0-3.5 wt%的范围内,而IPH1.50(1)的PBI含量在5.5-7.8 wt%的范围内。
产品是透明,有弹性和水溶胀性的材料。这表明两个网络(PHEA和IPH)在微米级别上没有相位分离。为了除去所有副产物,在进一步分析之前,将IPH在蒸馏水中洗涤7天,因为无法部分破坏PBI起始网络,而无法对其进行洗涤。发现凝胶含量为86-88%,表明有效的交联。在IPH1.50(1)的示例中,通过扫描电子显微镜(SEM)结合能量色散X射线(EDX),透射电子显微镜(TEM)和原子力显微镜(AFM)研究了所得材料的结构。其中应包含从起始原料计算得出的7.8 wt%PBI(图3)。如图3a所示,与PBI结合的溴作为季铵盐功能的抗衡离子很好地分布在基质中。IPH截面的TEM和AFM显示出这种网络典型的独特纳米结构。AFM中的暗相归因于PBI。分离后一相并将其包埋在该组合物典型的渗透PHEA相中(8/92 wt/wt)。PBI相的大小约为3.6 nm。两种方法均未观察到较大的相分离。

图3. a–c)在37°C下清洗7天后的IPH1.50(1)的扫描电子显微镜(SEM),透射电子显微镜(TEM),原子力显微镜(AFM,c)图像 在水里。a)插入的方框标出了一个典型区域,在该区域中累积了通过SEM-EDX分析标准元素的计数。d)该表显示了在水中洗涤7天后通过SEM-EDX测定的IPH1.50(1)和IPH1.74(1)中的溴含量以及从这些值计算得出的IPH中相应的PBI含量。e)分别处于干燥状态的典型PHEA(1),IPH1.50(1)和IPH1.74 /(1)网络的照片。
制备了一系列在PHEA相中具有不同交联剂含量的系列,以研究网络水溶胀的可控性。如图4所示,IPH的可溶胀性受PHEA相中交联剂的量控制。PBI含量较低的IPH1.74网络与相应的交联PHEA膨胀程度相同。与PHEA网络相比,IPH1.50中较高的PBI含量导致较高的溶胀,表明PBI相开始在该含量下影响水凝胶的性能。但是,对于IPH,未发现PBIN的高溶胀速率,而IPH需要24小时才能达到平衡溶胀。

图4.经过PHEA,IPH1.50和IPH1.74网络(分别为1 wt%(灰色),3 wt%(灰色)或5 wt%(白色))的PHEA,IPH1.50和IPH1.74网络72小时后,在双蒸水中的溶胀度 相对于HEA的使用量,GDMA作为交联剂。
通过使细菌细胞与PBS缓冲液中的表面接触3小时来测试水凝胶的抗菌性能。然后通过超声去除粘附的细胞,并在琼脂平板上计数菌落形成单位(CFU)。将发现的CFU数量等于存活细菌细胞的数量,与在没有PBI的相应PHEA水凝胶上发现的CFU数量进行比较。结果显示两种IPH的金黄色葡萄球菌和大肠杆菌的log 5减少(见图5a)。如图5b所示,已生长的细菌菌落到达水凝胶表面,但不在水凝胶上生长,即存在没有可见的抑制区,表明抑菌剂有毒浓度的浸出。另外,将水凝胶IPH1.50(1)在生长培养基中孵育3小时,其量用于在37°C下测试抗菌活性(50 mg水凝胶/1 mL生长培养基)。
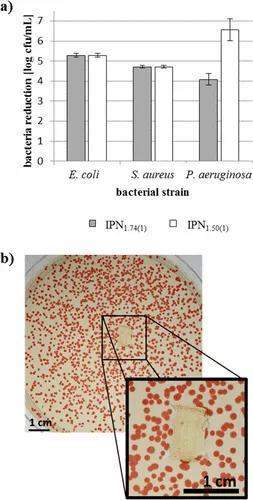
图5. a)孵育后,经过水洗的网络IPH1.74(1)(在37°C时为12天)和IPH1.50(1)(在37°C时为27天)表面的细菌细胞减少 在PBS中3小时的时间。b)将金黄色葡萄球菌菌落喷洒在带有嵌入式IPH1.50(1)网络的琼脂平板上(用水洗涤7天),在37°C孵育过夜并用TTC染色后形成的图像。
参考文献:
doi.org/10.1021/acsami.7b10049
版权声明:「水凝胶」是由专业博士(后)创办的非赢利性学术公众号,旨在分享学习交流高分子聚合物材料学的研究进展。上述仅代表作者个人观点且作者水平有限,如有科学不妥之处,请予以下方留言更正。如有侵权或引文不当请联系作者修正。商业转载请联系编辑或顶端注明出处。感谢各位关注!
责任编辑:
